BIOSYNTEZA I UDZIAŁ KOENZYMU Q10 W METABOLIZMIE KOMÓRKI
Rozdział opracowany we współpracy z prof. dr hab. med. Januszem Gregerem
Rozdział 1 z publikacji Farmakologia kliniczna koenzymu Q10 , prof. dr hab. med. Józef Drzewoski.
Wstęp
W roku 1940 Morre i Rajagopal [191] stwierdzili, że we frakcji lipidowej uzyskanej z mitochondriów wątroby szczura występuje wrażliwa na zasady substancja, charakteryzująca się prążkiem widma o długości 275 mm. W 10 lat później Morton [196] odkrył w śluzówce jelita cienkiego związek o podobnych właściwościach, a wkrótce potwierdzono jego obecność w wielu narządach różnych gatunków zwierząt [29,72]. Początkowo sądzono, że związek ten, nazwany koenzymem Q, ma strukturę steroidu, szybko jednak ustalono, że należy on do chinonów. Powszechność jego występowania sprawiła, że określono go także mianem ubichinonu ( wszechobecny !) [195].
Ustalenie struktury koenzymu Q jako 2,3-dimetoksy, 5-metylo, 6-poliprenylo, 1,4-benzochinonu (ryc.1) zawdzięczamy grupie Mortona i Greena [166, 197, 233].

Rycina 1. Struktura koenzymu Q (ubichinonu)
Uzyskano dane, że występuje wiele homologów koenzymu Q, różniących się długością łańcucha poliprenylowego. Z drożdży i pleśni wyizolowano ubichinony zawierające łańcuch poliprenylowy zbudowany z sześciu, siedmiu, ośmiu i dziewięciu jednostek izoprenoidowych [167, 168]. Koenzym Q u człowieka zawierający łańcuch poliprenylowy zbudowany z dziesięciu jednostek izoprenoidowych [108], określa się mianem koenzymu Q10 (CoQ10). Obecność CoQ10 stwierdzono początkowo w mitochondriach, a następnie we frakcji mikrosomalnej oraz w jądrach komórkowych [3].
Biosynteza koenzymu Q
Koenzym Q jest syntetyzowany we wszystkich tkankach i komórkach w ilości wystarczającej do wypełniania swojej roli w warunkach prawidłowej homeostazy organizmu. W stanach chorobowych, upośledzających funkcję tkanek i narządów, biosynteza lokalna jest
niewystarczająca i wymaga redystrybucji drogą krwionośną celem uzupełnienia jego zawartości [43]. Koenzym Q powstaje z tyrozyny i kwasów tłuszczowych, przy czym kluczowym metabolitem syntezy pierścienia koenzymu Q jest 4-hydroksybenzoesan bądź 3-metoksy 4-hydroksybenzoesan [88]. Podobną rolę w syntezie grupy poliprenylowej spełnia farnezylopirofosforan.
4-hydroksybenzoesan tworzy się w wyniku deaminacji tyrozyny do
4-hydroksyfenylopirogronianu i jego dekarboksylacji ( schemat 1, I-III );
3-metoksy 4-hydroksybenzeoesan powstaje w następstwie alternatywnego przekształcenia tyrozyny do amin katecholowych i kwasu migdałowego (schemat 2, I-VIII) [266]. Synteza grupy poliprenylowej rozpoczyna się od powstania 3-hydroksy 3-metyloglutarylo koenzymu A (HMG-CoA), który po redukcji i fosforylacji przekształcony zostaje do 3-fosfo 5-pirofosfomewalonianu (schemat 3, I -V). W następstwie działania dekarboksylazy oraz izomerazy związek V zamieniony zostaje na dwie jednostki pirofosfoizoprenowe. Powstaje z nich farnezylopirofosforan, będący poliprenolem trójczłonowym (schemat 3, VI-IX). Transprenylotransferaza wydłuża farnezylopirofosforan do dziesięcioczłonowego poliprenylofosforanu, z którego następnie dziesięcioczłonowa jednostka poliprenylowa przeniesiona zostaje na 4-hydroksybenzoesan (bądź – alternatywnie – na 3-metoksy 4-hydroksybenzoesan) w reakcji katalizowanej przez transferazę poliprenylową [160]. Powstający w ten sposób 4-hydroksy- 3-poliprenylobenzoesan (schemat 1, IV, schemat 3, XII) po dekarboksylacji, kolejnych hydroksylacjach i metylacjach dokonujących się z udziałem S-adenozylometioniny przekształca pierścień benzenowy w chinonowy i ostatecznie prowadzi do koenzymu Q (schemat 1, V – X, schemat 2, X – XIV) [179].
Należy zauważyć, że przedstawiony w schemacie 3 szlak metaboliczny zwany szlakiem mewalonianu, prowadzi także do syntezy dolicholu, a w końcowym etapie (po syntezie skwalenu z farnezylopirofosforanu i przemianie skwalenu w kilka dalszych metabolitów) do syntezy cholesterolu. Związek pomiędzy syntezą koenzymu Q i syntezą cholesterolu potwierdziły badania, w których szybkość powstawania obu związków mierzona była w obecności inhibitorów przemiany HMG-CoA w mewalonian. Badania te wykazały, że hamowanie syntezy mewalonianu nie tylko obniża stężenie cholesterolu we krwi, ale również zmniejsza zawartość koenzymu Q w sercu, mięśniach szkieletowych, wątrobie i w innych tkankach [4].
Biosynteza ubichinonu ulega zwiększeniu w warunkach stresu oksydacyjnego, w wyniku działania zimna, wysiłku fizycznego i hormonów tarczycy. Ostatnie badania wskazują również, że produkty rozpadu CoQ powstające w wyniku peroksydacji lipidów mogą stymulować biosyntezę związku macierzystego [68]. Willis i wsp. sugeruja, że biosynteza CoQ jest sprawniejsza w obecności witaminy B6 [258].
Fibraty należące do grupy leków działających na tzw. receptor aktywowany przez proliferatory peroksysomów (peroxisome proliferator – activated receptor – PPAR), zmniejszają we krwi zwierząt doświadczalnych stężenie cholesterolu, zwiększając równocześnie stężenie koenzymu. Badania na ludziach nie potwierdziły tego spostrzeżenia. Wykazano w nich, że u osób z hiperlipidemią – gemfibrozyl-jeden z fibratów- wręcz przeciwnie, zmniejsza stężenie CoQ10 we krwi [5]. Statyny -leki hamujące reduktazę HMG- CoA – obniżają zarówno stężenie cholesterolu, jak i ubichinonu [68]. Z drugiej strony niektórzy autorzy uważają, że centralna regulacja szlaku mewalonianu przez reduktazę HMG – CoA ma mniejsze znaczenie w biosyntezie CoQ niż cholesterolu [43].
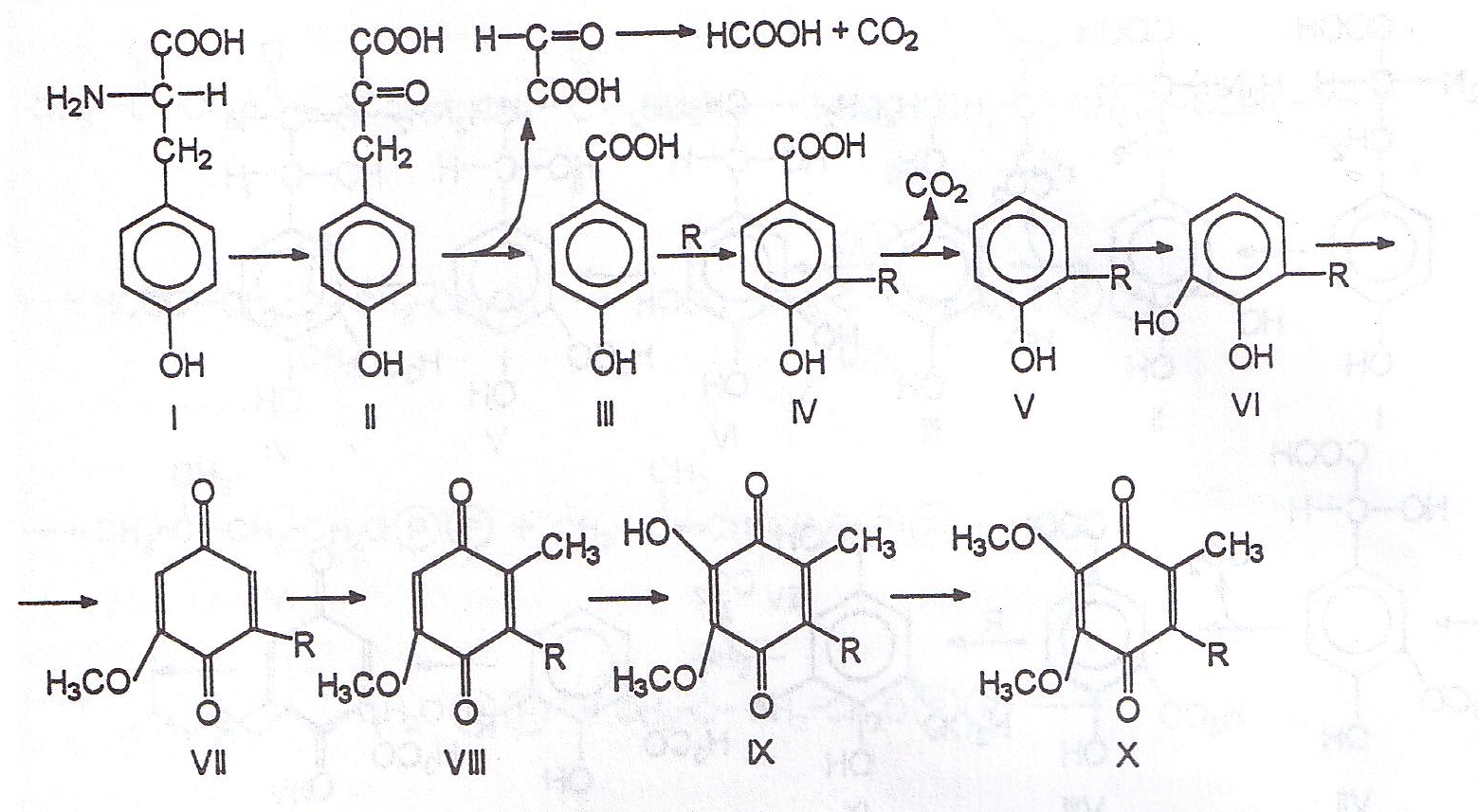
Schemat 1 – Synteza koenzymu Q
Schemat 1 – Synteza koenzymu Q:
I – tyrozyna
II – 4-hydroksy fenylopirogronian
III – 4-hydroksy benzoesan
IV – 4-hydroksy 3-poliprenylo benzoesan
V – 2-poliprenylofenol
VI – 6-hydroksy 2-poliprenylofenol
VII – 6-metoksy 2-poliprenylo 1,4-benzochinon
VIII – 6-metoksy 3-metylo 2-poliprenylo 1,4-benzochinon
IX – 5-hydroksy 6-metoksy 3-metylo 2-poliprenylo
1,4-benzochinon
X – koenzym Q
R – grupa poliprenylowa

Schemat 2 – Alternatywna droga syntezy koenzymu Q
Schemat 2 – Alternatywna droga syntezy koenzymu Q
I – tyrozyna
II – dihydroksyfenylolanina (DOPA)
III – dopamina, IV – noradrenalina
V – 3-metoksynoradrenalina
VI – aldehyd-3-metoksy-4-hydrokysy migdałowy
VII – kwas 3-metoksy-4-hydroksy migdałowy
VIII – 3-metoksy-4-hydroksy benzoesan
IX – 3-metoksy-4-hydroksy-5-poliprenylo benzoesan
X – 6-metoksy-2-poliprenylofenol
XI – 6-metoksy-2-poliprenylo-1,4-benzochinon
XIII – 5-hydroksy-6-metoksy-3-metylo-2-poliprenylo-1,4-benzochinon,
XIV – koenzym Q
R – grupa poliprenylowa

Schemat 3 – Synteza 4-hydroksy 3-poliprenylo benzoesanu
Schemat 3 – Synteza 4-hydroksy 3-poliprenylo benzoesanu
I – acetoacetylo koenzym A
II – acetylo koenzym A
III – 3-hydroksy 3-metylo glutarylo koenzym A
IV – mewalonian
V – 3-fosfo 5-pirofosfomewalonian
VI – izopenylo pirofosforan
VII – dimetyloallilopirofosforan
VIII – genarylopirofosforan
IX – farnezylopirofosforan
X – poliprenylopirofosforan
XI – 4-hydroksybenzoesan
XII – 4-hydroksy 3-poliprenylobenzoesan
Biologiczna rola koenzymu Q
Hatefi i wsp. wykazali, że w mitochondriach koenzym Q ulega redukcji w obecności NADH + H+, bursztynianu a także substratów utlenianych przez dehydrogenazy współpracujące z NAD+ (jabłczan, pirogronian, – hydroksymaślan) [106, 107]. Reakcje redukcji koenzymu Q prowadzące od bezochinonu do hydrochinonu przebiegają zgodnie z równaniami przedstawionymi na schemacie 4.
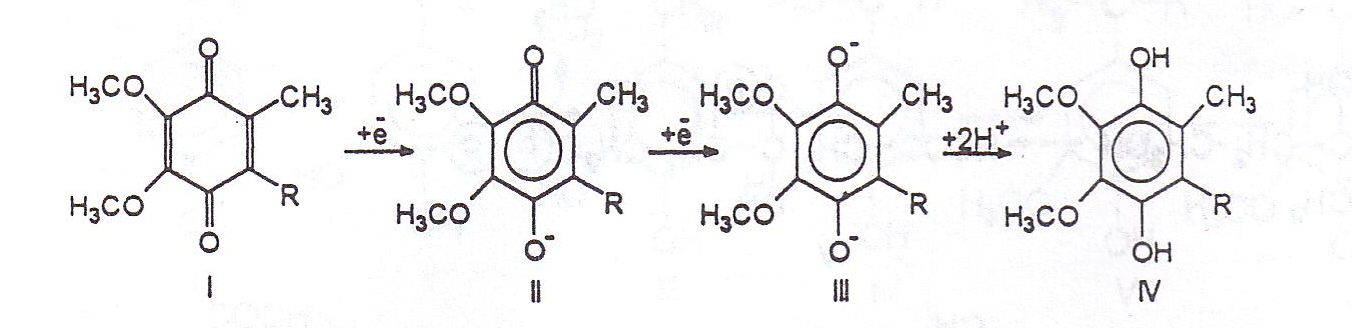
Schemat 4 – Redukcja koenzymu Q dokonująca się w mitochondriach
Schemat 4 – Redukcja koenzymu Q dokonująca się w mitochondriach.
I – koenzym Q forma utleniona (benzochinon),
II – rodnik benzochinonu,
III – jon hydrochinonu,
IV – koenzym Q (hydrochionon),
R – grupa poliprenylowa
Wartość biologicznego potencjału wzorcowego dla formy utlenionej i zredukowanej koenzymu Q wynosi 0,1 V. Jakkolwiek zdolność redukcji koenzymu Q zależna jest głównie od struktury pierścienia, istnieje wyraźna zależność pomiędzy długością łańcucha poliprenylowego a aktywnością enzymów, których koenzymy utleniane są przez koenzym Q. W przypadku kiedy koenzym Q zawiera resztę poliprenylową zbudowaną z dziesięciu jednostek izoprenoidowych, dominującą aktywnością jest zdolność utleniania zredukowanego NADH + H+; odwrotnie, kiedy łańcuch poliprenylowy zawiera tylko dwie jednostki izoprenoidowe, przeważa utlenianie bursztynianu (tj. utlenienie zredukowanego FADH2) [163, 164]. Prawdopodobnie jest to związane ze zmianą organizacji koenzymu Q o zmiennej długości grupy poliprenylowej w strukturze wewnętrznej błony mitochondrialnej.
Główna biologiczna rola koenzymu Q sprowadza się do jego udziału w łańcuchu oddechowym. Łańcuch oddechowy zlokalizowany w wewnętrznej błonie mitochondrialnej stanowi szlak metaboliczny, w którym zredukowane koenzymy oksydoreduktaz (NADH + H+, FMNH2, FADH2 , cytochromy) utleniają się w obecności tlenu cząsteczkowego do H2O, a powstała w wyniku tych reakcji energia, wykorzystywana jest do fosforylacji ADP do ATP. Fosforylacja ta dokonująca się jedynie w obecności tlenu i będąca odwróceniem reakcji katalizowanej przez ATP-azę, została nazwana fosforylacją oksydacyjną. Łańcuch oddechowy składa się z czterech kompleksów [66] i obecnego również w wewnętrznej błonie mitochondrialnej kompleksu ATP-azy [231]. Chociaż w każdym z tych kompleksów przebiegają inne reakcje, ich wspólną cechą jest to, że wszystkie one są reakcjami utleniania i redukcji, przebiegającymi ze spadkiem energii swobodnej (tj. uwalniającymi energię do otoczenia).
Kompleks I będący reduktazą NADH + H+ / koenzym Q, katalizuje reakcję:
NADH + H+ + koenzym Q -> NAD+ + koenzym QH2.
Kompleks II, w którym zlokalizowana jest aktywność reduktazy
bursztynianu / koenzym Q, katalizuje reakcję utlenienia
bursztynianu do fumaranu zgodnie z równaniem:
HOOC – CH2 – CH2 – COOH + FAD -> HOOC – CH = CH – COOH + FADH2,
FADH2 + koenzym Q -> FAD + koenzym QH2
W kompleksie III zawarta jest aktywność reduktazy koenzym Q / cytochrom c, która katalizuje reakcję:
Koenzym QH2 + 2cytochrom c(Fe3+) -> koenzym Q + 2cytochrom (Fe2+) + 2H+
W kompleksie IV przebiegają reakcje utlenienia cytochromu c i kolejno reakcje redukcji i utlenienia cytochromów a i a3. Oksydaza cytochromowa będąca składnikiem tego kompleksu, przenosi elektrony na O2 i redukuje go do jonu O2-, a jon ten, wchodząc w reakcję z protonami uwolnionymi w reakcjach kompleksu III, tworzy cząsteczkę wody zgodnie z równaniem:
4H+ + 2O2- -> 2H2O
W fundamentalnych pracach dotyczących sprzężenia reakcji łańcucha oddechowego ze zdolnością do fosforylacji ADP do ATP w obecności tlenu, Mitchell wykazał [187], że energia jaka powstaje w wyniku reakcji utlenienia i redukcji zachodzących w poszczególnych kompleksach łańcucha oddechowego, wykorzystana zostaje do pompowania protonów z matriks mitochondrialnej przez wewnętrzną błonę mitochondrialną do przestrzeni międzybłonowej. Prowadzi to do wytworzenia różnicy stężeń protonów, która po obu stronach wewnętrznej błony mitochondrialnej wynosi 1,4 jednostek pH. Znając potencjał błony wewnętrznej (0,14 V) pozwala to wyznaczyć całkowity potencjał elektrochemiczny błony wynoszący 0,224 V, co odpowiada swobodnej energii 5,15 kcal/mol przemieszczanych protonów.
Utlenienie 1 mola NADH + H+ do cząsteczki H2O w łańcuchu oddechowym związane jest z przepływem 6 moli protonów przez wewnętrzną błonę mitochondrialną. Energia swobodna towarzysząca temu procesowi wynosi zatem 31 kcal ( 5,15 x 6), a wykorzystana przez mitochondrialną ATP-azę (która katalizując reakcję ADP + H2PO4– ® ATP + H2O staje się teraz syntazą ATP), zachowana zostaje w komórce.
Z przedstawionego wywodu wynika, że nieprawidłowe funkcjonowanie łańcucha oddechowego spowodowane np. niedoborem CoQ10 będzie manifestowało się niedostatecznym wytwarzaniem związków wysokoenergetycznych. W konsekwencji zmniejszona zostanie sprawność komórki, tkanki lub całego narządu i wystąpią określone objawy kliniczne.
Koenzym Q uczestniczy w reakcjach kompleksu I, II i III łańcucha oddechowego i jest nie tylko głównym związkiem gromadzącym atomy wodoru dostarczane przez zredukowane koenzymy dehydrogenaz (NADH + H+, FMNH2, FADH2, kompleksy I i II), ale także stanowi podstawowe źródło protonów i elektronów, które zostają wykorzystane w reakcjach kompleksów III i IV (ryc. 2).
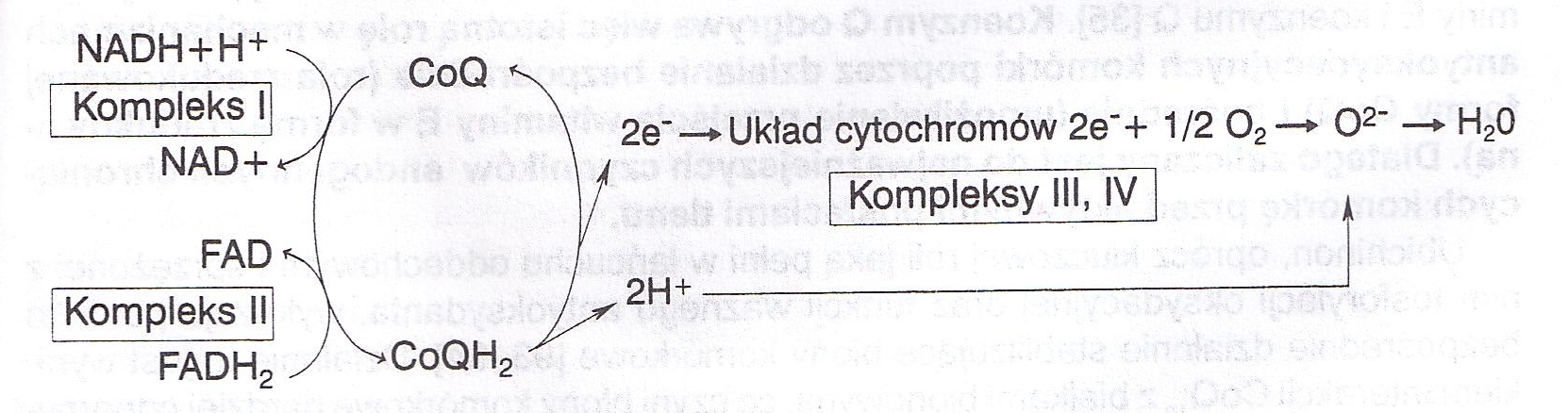
Rycina 2 Schemat łańcucha oddechowego (uproszczony)
Koenzym Q poza mitochondriami występuje również we frakcji mikrosomalnej, gdzie uczestniczy w transporcie elektronów przez błony aparatu Golgiego [41]. Proces ten nie jest jednak sprzężony z generowaniem energii. Jego prawdopodobna rola polega na uczestnictwie w mikrosomalnym systemie utleniania, w którym biorą udział zredukowane koenzymy oksydoreduktaz oraz cytochrom P-450. System ten stanowi główny szlak metaboliczny wykorzystywany do utleniania ksenobiotyków, a także do hydroksylacji steroidów [159].
Jednoelektronowe reduktazy chinonowe działające w obecności NADPH + H+ oraz cytochromu P-450, redukują chinony do semichinonów. Te ostatnie reagując z O2 utleniają się ponownie do chinonów, wytwarzając jednocześnie rodnik ponadtlenkowy O2·. W reakcji katalizowanej przez dysmutazę ponadtlenkową, rodnik ten zostaje utleniony do H2O2 , który z kolei jest np. wykorzystywany przez peroksydazę glutationu do utlenienia glutationu zredukowanego. Chinony mogą być jednak redukowane nie tylko do semichinonów, lecz także do hydrochinonów. Ponieważ hydrochinony reagując z O2 nie wytwarzają rodnika ponadtlenkowego, zachowują się tym samym jak antyoksydanty.
Koenzym Q występuje w formie zredukowanej nie tylko w wewnętrznej błonie mitochondrialnej , ale również w osoczowej frakcji lipidowej. W związku z tym może zapobiegać utlenianiu LDL, a tym samym zmniejszać ryzyko miażdżycy. Ochronna rola hydrochinonu koenzymu Q w przypadku stosowania leków o strukturze chinonowej (adriamycyna, mitomicyna, 5-fluorouracyl) ma prawdopodobnie analogiczny mechanizm [67]. Zakłada się, że CoQ10 neutralizuje wolne rodniki powstające w procesie biotransformacji m.in. antybiotyków antracyklinowych, zmniejszając ryzyko wystąpienia powikłań kardiologicznych po tych lekach [9, 61,130].
Podstawową rolą naturalnych antyoksydantów takich jak witamina C, a przede wszystkim witamina E, jest ochrona komórek przed uszkodzeniem ich przez wolne rodniki tlenowe. Kwas askorbinowy pełni rolę zmiatacza rodników znajdujących się w fazie wodnej komórki, natomiast w obszarach hydrofobowych rolę tą przejmuje witamina E. Należy podkreślić, że antyoksydacyjne działanie CoQ nie zależy od witaminy E, natomiast działanie witaminy E zależy od obecności tego pierwszego. Zredukowana forma koenzymu Q obecna w strukturach hydrofobowych komórki, w następstwie interakcji z witaminą E, regeneruje zredukowaną formę witaminy (tj. formę z zachowanym pierścieniem 6-hydroksychromanu) wykazującą aktywność antyoksydacyjną [22]. Udział koenzymu Q w utrzymaniu antyoksydacyjnej aktywności witaminy E został potwierdzony w doświadczeniach na zwierzętach, którym podawano samą witaminę E lub witaminę E w połączeniu z koenzymem Q. Homogenaty nerek, serca, płuc i śledziony tych zwierząt, wykazywały wysoką aktywność antyoksydacyjną tokoferolu w przypadku jednoczesnej podaży witaminy E i koenzymu Q [35]. Koenzym Q odgrywa więc istotną rolę w mechanizmach antyoksydacyjnych komórki poprzez działanie bezpośrednie (rola zredukowanej formy CoQ) i pośrednie (umożliwienie przejścia witaminy E w formę zredukowaną). Dlatego zaliczany jest do najważniejszych czynników endogennych chroniących komórkę przed aktywnymi postaciami tlenu.
Ubichinon, oprócz kluczowej roli jaką pełni w łańcuchu oddechowym i sprzężonej z nim fosforylacji oksydacyjnej oraz funkcji ważnego antyoksydanta, wykazuje ponadto bezpośrednie działanie stabilizujące błony komórkowe [93, 94]. Działanie to jest wynikiem interakcji CoQ10 z białkami błonowymi, co czyni błony komórkowe bardziej odpornymi na działanie czynników szkodliwych oraz zapobiega wypływowi z komórki różnych substancji (H2O, Mg2+, K+, Ca2+) niezbędnych dla jej prawidłowego funkcjonowania.
Podkreśla się również korzystny wpływ ubichinonu na integralność wolnych kanałów wapniowych podczas epizodów niedokrwienia mięśnia sercowego [93, 94, 202].
Podsumowanie
Koenzym Q10, syntezowany w komórkach człowieka z tyrozyny i kwasów tłuszczowych, jest integralnym składnikiem łańcucha oddechowego, pełniąc w nim rolę ruchomego przenośnika elektronów ze zredukowanych koenzymów (NADH + H+, FMNH2, FADH2) na cytochromy. Uczestniczy więc aktywnie w podstawowym dla utrzymania życia procesie tj. wytwarzaniu energii niezbędnej dla prawidłowego przebiegu fosforylacji ADP do ATP.
Związek występuje w formie utlenionej (chinon) lub zredukowanej (hydrochinon), wykazującej właściwości antyoksydacyjne. Chroni to komórkę przed toksycznymi skutkami działania wolnych rodników tlenowych, powstających w wyniku działania różnych czynników środowiskowych (np. promienie słoneczne) oraz w wielu endogennych procesach biochemicznych w organizmie człowieka, w tym np. podczas biotransformacji niektórych leków.
Właściwości te uzasadniają wykorzystywanie CoQ10 w terapii chorób, które mogą być wynikiem niedostatecznego wytwarzania energii lub działania wolnych rodników.
Za celowością podejmowania prób szerszego wykorzystywania CoQ10 w lecznictwie przemawia również działanie stabilizujące błony komórkowe oraz korzystny wpływ tego związku na kanały wapniowe.